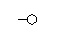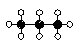Grundstoffer i plastmaterialer Grundstoffer i plastmaterialer
 Kulbrinter Kulbrinter
 Valenser og atombindinger Valenser og atombindinger
 Dobbelt- og 3-dobbelt-bindinger Dobbelt- og 3-dobbelt-bindinger
Alle materialer er opbygget af en mængde små enheder, molekyler, som er sammensat af en eller flere atomer.
I de fleste plastmaterialer finder vi hovedsagelig grundstofferne:
Kulstof (C) - Brint (H) - Ilt (O) - Klor (Cl) -
Kvælstof (N) - Fluor (F) - samt få andre.
En af betingelserne for at tilhøre plastgruppen er, at materialet væsentligst består af organiske stoffer, hvorfor kulstof naturligt indgår i alle plastmaterialer med undtagelse af silicon-plastene.
De C-forbindelser, der anvendes, tages fra de lettest tilgængelige i naturen, som naturgas og olie. Da C og H-atomer indgår, kaldes de for kulbrinter. Man kender i dag op til ½ mill. forskellige kulbrinteforbindelser.
| C er Tetravalent (4) |
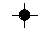 |
| H er monovalent (1) |
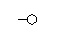 |
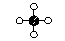
Den simpleste sammensætning af C og H atomer vil da se således ud, idet de frie elektroner vil danne elektronpar.
| Dette molekyle, CH4, hedder Methan (Naturgas) |
 |
C kan også danne elektronpar med andre C-atomer, f.eks. således.:
| Dette molekyle, C3H8, hedder propan (flaskegas). |
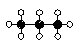 |
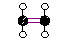
C-atomer kan endvidere danne dobbelt og 3-dobbelte elektronpar.
Et eksempel herpå er Ethylen, C2H4, som udvindes ved destilation
af olie.
| Her er dobbeltbinding mellem C-atomerne. |
 |
|






 Grundstofatomer i plastmaterialer
Grundstofatomer i plastmaterialer Kulbrinter
Kulbrinter